Когда в научном мире происходит что-то новое, меняющее привычный ход вещей, это может найти отражение в нескольких статьях строго научных журналов. Но если это новое явление задевает несколько направлений медицины и в каждой из них с регулярностью появляются новые прикладные исследования, а перспективы развития метода простираются на десятилетия вперед, то приходит пора публиковать большой материал в Nature. Недавно журнал писал про экзосомы
Подобные обзорные статьи нужны профессиональному сообществу, чтобы «сверить часы» - обрести общую терминологию, закрепить известные на сегодня технологический подходы и сферы применения. Мы перевели ее на русский для вас
Подобные обзорные статьи нужны профессиональному сообществу, чтобы «сверить часы» - обрести общую терминологию, закрепить известные на сегодня технологический подходы и сферы применения. Мы перевели ее на русский для вас
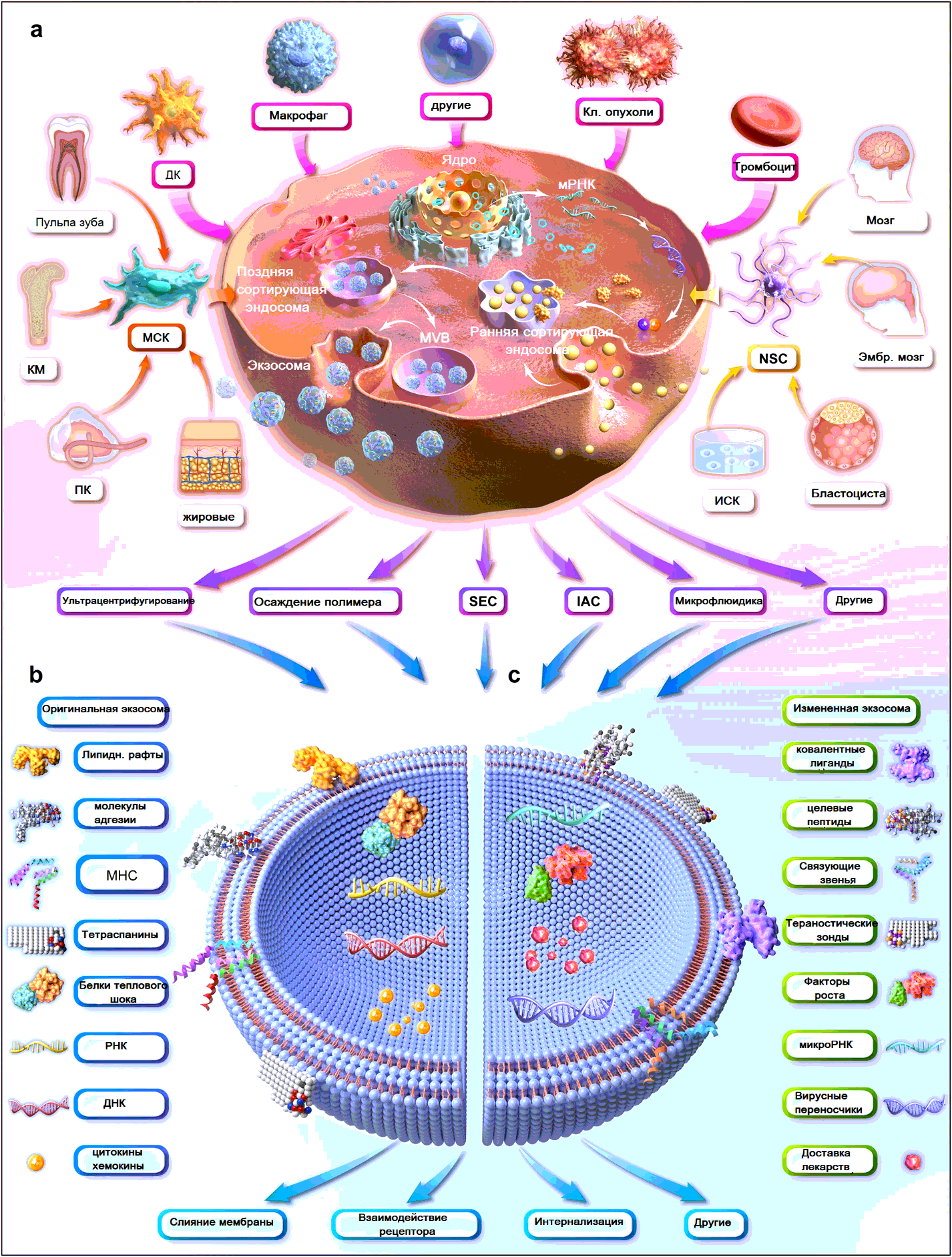
Иллюстрация основных этапов экзосомной терапии (рисунок создан с использованием Autodesk 3ds Max 2023). а) получение и очистка экзосом (МСК и НСК (NSC) используются в качестве примеров мультипотентных стволовых клеток). в) содержание природных экзосом. c) модификация экзосом. (Костный мозг BM, дендритные клетки DC, иммуноаффинная хроматография IAC, индуцированные плюрипотентные стволовые клетки iPSC (ИСК), основной комплекс гистосовместимости MHC, микроРНК, мезенхимальные стволовые клетки MSC, многовезикулярное тельце MVB, нервные стволовые клетки NSC, хроматография с исключением размера SEC, пуповина ПК). MHC – главный комплекс гистосовместимости
Стволовые клетки - это популяция недифференцированных клеток, обладающих уникальными способностями к самообновлению и воссозданию функциональных тканей. В первую очередь они классифицируются по их потенциалу дифференцировки, происхождению и наследственной прогрессии. В зависимости от их активности стволовые клетки могут быть тотипотентными, плюрипотентными, мультипотентными, олигопотентными и унипотентными. Стволовые клетки существуют как в эмбриональных, так и во взрослых клетках. Эмбриональные стволовые клетки (ЭСК) и индуцированные плюрипотентные стволовые клетки (ИПСК) являются лучшими примерами плюрипотентных стволовых клеток, в то время как взрослые мультипотентные стволовые клетки представлены гемопоэтическими стволовыми клетками (ГСК), мезенхимальными стволовыми клетками (МСК), нервными стволовыми клетками (НСК) и эндотелиальными стволовыми клетками/клетками-предшественниками (ЭПК). (рис. 1а). Все эти подтипы стволовых клеток были широко опробованы для лечения заболеваний человека.
Экзосомы являются наноразмерными, сферическими и состоящими из липидного бислоя одномембранными внеклеточными везикулами, которые действуют как межклеточные посредники. Экзосомы считаются миниатюрными версиями родительских клеток, отчасти потому, что экзосомы определенного типа клеток содержат специфические для клеток или уникальные наборы биомолекул. Кроме того, было обнаружено, что стволовые клетки функционируют паракринным образом благодаря своему растворимому секретому, включая экзосомы. Другими словами, экзосомы, полученные из стволовых клеток (SC-Exo), наследуют сходные терапевтические эффекты от родительских клеток, например, противовоспалительные, иммуномодулирующие и регенерирующие ткани. В совокупности экзосомы, полученные из стволовых клеток, являются мощным заменителем терапии стволовыми клетками, не обладая теми недостатками, которые присущи их клеточным аналогам.
Передклиническим применением экзосомы должны быть подготовлены и оптимизированы с точки зрения производства, очистки и модификации. За последние годы было опубликовано множество медицинских обзоров, в которых анализировались эти передовые методы лечения экзосомами.
В зависимости от того, были ли экзосомы искусственно модифицированы, они в широком смысле подразделяются на естественные и сконструированные, экзосомы животного и растительного происхождения. В настоящее время экзосомы в основном классифицируются в зависимости от типа их родительских клеток. Они могут образовываться практически во всех типах клеток человека. К таковым относятся, макрофаги, дендритные клетки (DC), тромбоциты, стволовые клетки и даже опухолевые клетки.
Экзосомы можно найти во всех жидкостях организма, таких как кровь, слюна, моча, плазма, слезы, сперма, амниотическая жидкость, и даже грудное молоко. Экзосомы, полученные из жидкости организма, являются высокостабильным резервуаром биомаркеров заболеваний, которые помогают проводить жидкостную биопсию в различных клинических условиях, таких как рак, сердечно-сосудистые заболевания и перинатальные нарушения.
Существуют различные методы увеличения производства экзосом, которые подразделяются на биохимические стратегии (например, LPS, BMP-2, HIF-1a, IFN-γ и TNF-a), физические стратегии (гипоксия, тепловой стресс и голодание), механические стратегии (напряжение сдвига и трехмерное культивирование) и инструментальные стратегии (биореакторы из полого волокна и биореакторы в резервуарах с перемешиванием). Однако универсального подхода не существует, поскольку все эти методы имеют свои преимущества и недостатки.
Например, ультрацентрифугирование считается золотым стандартом для экстракции экзосом. Хотя оно требует минимального количества реагентов и опыта, затраты времени; высокая стоимость, низкая эффективность и совместное выделение липопротеинов ограничивают его широкомасштабное применение. Иммуноаффинная хроматография - это технология разделения, основанная на специфическом связывании антител и лигандов. Она быстра и обеспечивает высокую чистоту, специфичность и выход продукта. Однако используемое соединение антиген/белок должно быть экспрессировано на поверхности экзосом. Методы выделения, основанные на определении размера, в основном относятся к ультрафильтрации и хроматографии с исключением размера, которые являются быстрыми и пригодными для крупномасштабных применений. Но закупорка пор, потеря экзосом и низкая чистота затрудняют популяризацию этого метода.
Модификация экзосом
Экзосомы могут быть биохимически модифицированы для расширения, изменения или улучшения их терапевтического эффекта. Модификация экзосом подразделяется на внутренние стратегии (например, введение лекарственных препаратов) и внешние стратегии (например, модификация поверхности). С одной стороны, экзосомы могут быть идеальным терапевтическим носителем для доставки лекарственных препаратов, нуклеиновых кислот и вакцин благодаря их стабильности, неиммуногенности и нацеленности на клетки-реципиенты. Существуют различные методы загрузки (предварительной и последующей).
С другой стороны, модификация поверхности экзосом осуществляется с помощью генной инженерии мембраны экзосом или родительских клеток, химического соединения лигандов-мишеней, электростатического взаимодействия и технологии магнитных наночастиц. Основной целью модификации поверхности является избирательная доставка экзосом к клеткам-мишеням для точного лечения.
Хранение экзосом
В настоящее время для длительного хранения экзосом используются, в основном, криоконсервация, лиофилизация и распылительная сушка. Температура и антифриз - два наиболее важных ингредиента для криоконсервации. Хранение при температуре 4 °C может ослабить биологическую активность и уменьшить содержание белка в экзосомах, в то время как оптимальной считается температура -80 °C, которая оказывает наименьшее влияние на морфологию экзосом и их содержание. Недавнее исследование показало, что лиофилизация с использованием криопротектора может сохранять активность экзосомальных белков и РНК примерно в течение 4 недель даже при хранении при комнатной температуре. Наконец, в отличие от сублимационной сушки, распылительная сушка представляет собой одноступенчатый процесс, что позволяет снизить потребность в дорогостоящем оборудовании и длительном многоступенчатом измельчении.
ОРТОПЕДИЧЕСКАЯ И ТРАВМАТОЛОГИЧЕСКАЯ ХИРУРГИЯ И ТЕРАПИЯ ЭКЗОСОМАМИ, ПОЛУЧЕННЫМИ ИЗ СТВОЛОВЫХ КЛЕТОК
Перелом
Заживление переломов включает в себя фазу анаболического увеличения объема тканей и фазу катаболического ремоделирования тканей, которые контролируются различными факторами, такими как стволовые клетки, врожденные и адаптивные иммунные функции и стабильность. Биофармакологическое лечение переломов может проводиться локально (например, костный морфогенетический белок, BMP) или системно (например, паратиреоидный гормон, ПТГ). В качестве многообещающей альтернативы экзосомная терапия для заживления переломов в основном использует МСК, полученные из костного мозга, в качестве поставщика клеток. Предполагаемый механизм того, как экзосомы, полученные из MSC, способствуют заживлению переломов, заключается в следующем. Во-первых, для прогрессирования восстановления кости необходимы различные клетки, например, воспалительные клетки на стадии воспаления, эндотелиальные и мезенхимальные клетки-предшественники на фиброваскулярной стадии, остеобласты и хондроциты во время формирования кости и остеокласты во время ремоделирования костной ткани. Во-вторых, большинство этих клеток могут поглощать экзосомы, особенно остеобласты и эндотелиальные клетки сосудов, которые в наибольшей степени связаны с заживлением переломов. Наконец, при поглощении экзосом экспрессия генов в клетках-реципиентах изменяется, тем самым активируя различные сигнальные пути, вызывая различные клеточные и тканевые реакции и, в конечном счете, приводя к улучшению заживления переломов. (Рисунок 2)
Стволовые клетки - это популяция недифференцированных клеток, обладающих уникальными способностями к самообновлению и воссозданию функциональных тканей. В первую очередь они классифицируются по их потенциалу дифференцировки, происхождению и наследственной прогрессии. В зависимости от их активности стволовые клетки могут быть тотипотентными, плюрипотентными, мультипотентными, олигопотентными и унипотентными. Стволовые клетки существуют как в эмбриональных, так и во взрослых клетках. Эмбриональные стволовые клетки (ЭСК) и индуцированные плюрипотентные стволовые клетки (ИПСК) являются лучшими примерами плюрипотентных стволовых клеток, в то время как взрослые мультипотентные стволовые клетки представлены гемопоэтическими стволовыми клетками (ГСК), мезенхимальными стволовыми клетками (МСК), нервными стволовыми клетками (НСК) и эндотелиальными стволовыми клетками/клетками-предшественниками (ЭПК). (рис. 1а). Все эти подтипы стволовых клеток были широко опробованы для лечения заболеваний человека.
Экзосомы являются наноразмерными, сферическими и состоящими из липидного бислоя одномембранными внеклеточными везикулами, которые действуют как межклеточные посредники. Экзосомы считаются миниатюрными версиями родительских клеток, отчасти потому, что экзосомы определенного типа клеток содержат специфические для клеток или уникальные наборы биомолекул. Кроме того, было обнаружено, что стволовые клетки функционируют паракринным образом благодаря своему растворимому секретому, включая экзосомы. Другими словами, экзосомы, полученные из стволовых клеток (SC-Exo), наследуют сходные терапевтические эффекты от родительских клеток, например, противовоспалительные, иммуномодулирующие и регенерирующие ткани. В совокупности экзосомы, полученные из стволовых клеток, являются мощным заменителем терапии стволовыми клетками, не обладая теми недостатками, которые присущи их клеточным аналогам.
Передклиническим применением экзосомы должны быть подготовлены и оптимизированы с точки зрения производства, очистки и модификации. За последние годы было опубликовано множество медицинских обзоров, в которых анализировались эти передовые методы лечения экзосомами.
В зависимости от того, были ли экзосомы искусственно модифицированы, они в широком смысле подразделяются на естественные и сконструированные, экзосомы животного и растительного происхождения. В настоящее время экзосомы в основном классифицируются в зависимости от типа их родительских клеток. Они могут образовываться практически во всех типах клеток человека. К таковым относятся, макрофаги, дендритные клетки (DC), тромбоциты, стволовые клетки и даже опухолевые клетки.
Экзосомы можно найти во всех жидкостях организма, таких как кровь, слюна, моча, плазма, слезы, сперма, амниотическая жидкость, и даже грудное молоко. Экзосомы, полученные из жидкости организма, являются высокостабильным резервуаром биомаркеров заболеваний, которые помогают проводить жидкостную биопсию в различных клинических условиях, таких как рак, сердечно-сосудистые заболевания и перинатальные нарушения.
Существуют различные методы увеличения производства экзосом, которые подразделяются на биохимические стратегии (например, LPS, BMP-2, HIF-1a, IFN-γ и TNF-a), физические стратегии (гипоксия, тепловой стресс и голодание), механические стратегии (напряжение сдвига и трехмерное культивирование) и инструментальные стратегии (биореакторы из полого волокна и биореакторы в резервуарах с перемешиванием). Однако универсального подхода не существует, поскольку все эти методы имеют свои преимущества и недостатки.
Например, ультрацентрифугирование считается золотым стандартом для экстракции экзосом. Хотя оно требует минимального количества реагентов и опыта, затраты времени; высокая стоимость, низкая эффективность и совместное выделение липопротеинов ограничивают его широкомасштабное применение. Иммуноаффинная хроматография - это технология разделения, основанная на специфическом связывании антител и лигандов. Она быстра и обеспечивает высокую чистоту, специфичность и выход продукта. Однако используемое соединение антиген/белок должно быть экспрессировано на поверхности экзосом. Методы выделения, основанные на определении размера, в основном относятся к ультрафильтрации и хроматографии с исключением размера, которые являются быстрыми и пригодными для крупномасштабных применений. Но закупорка пор, потеря экзосом и низкая чистота затрудняют популяризацию этого метода.
Модификация экзосом
Экзосомы могут быть биохимически модифицированы для расширения, изменения или улучшения их терапевтического эффекта. Модификация экзосом подразделяется на внутренние стратегии (например, введение лекарственных препаратов) и внешние стратегии (например, модификация поверхности). С одной стороны, экзосомы могут быть идеальным терапевтическим носителем для доставки лекарственных препаратов, нуклеиновых кислот и вакцин благодаря их стабильности, неиммуногенности и нацеленности на клетки-реципиенты. Существуют различные методы загрузки (предварительной и последующей).
С другой стороны, модификация поверхности экзосом осуществляется с помощью генной инженерии мембраны экзосом или родительских клеток, химического соединения лигандов-мишеней, электростатического взаимодействия и технологии магнитных наночастиц. Основной целью модификации поверхности является избирательная доставка экзосом к клеткам-мишеням для точного лечения.
Хранение экзосом
В настоящее время для длительного хранения экзосом используются, в основном, криоконсервация, лиофилизация и распылительная сушка. Температура и антифриз - два наиболее важных ингредиента для криоконсервации. Хранение при температуре 4 °C может ослабить биологическую активность и уменьшить содержание белка в экзосомах, в то время как оптимальной считается температура -80 °C, которая оказывает наименьшее влияние на морфологию экзосом и их содержание. Недавнее исследование показало, что лиофилизация с использованием криопротектора может сохранять активность экзосомальных белков и РНК примерно в течение 4 недель даже при хранении при комнатной температуре. Наконец, в отличие от сублимационной сушки, распылительная сушка представляет собой одноступенчатый процесс, что позволяет снизить потребность в дорогостоящем оборудовании и длительном многоступенчатом измельчении.
ОРТОПЕДИЧЕСКАЯ И ТРАВМАТОЛОГИЧЕСКАЯ ХИРУРГИЯ И ТЕРАПИЯ ЭКЗОСОМАМИ, ПОЛУЧЕННЫМИ ИЗ СТВОЛОВЫХ КЛЕТОК
Перелом
Заживление переломов включает в себя фазу анаболического увеличения объема тканей и фазу катаболического ремоделирования тканей, которые контролируются различными факторами, такими как стволовые клетки, врожденные и адаптивные иммунные функции и стабильность. Биофармакологическое лечение переломов может проводиться локально (например, костный морфогенетический белок, BMP) или системно (например, паратиреоидный гормон, ПТГ). В качестве многообещающей альтернативы экзосомная терапия для заживления переломов в основном использует МСК, полученные из костного мозга, в качестве поставщика клеток. Предполагаемый механизм того, как экзосомы, полученные из MSC, способствуют заживлению переломов, заключается в следующем. Во-первых, для прогрессирования восстановления кости необходимы различные клетки, например, воспалительные клетки на стадии воспаления, эндотелиальные и мезенхимальные клетки-предшественники на фиброваскулярной стадии, остеобласты и хондроциты во время формирования кости и остеокласты во время ремоделирования костной ткани. Во-вторых, большинство этих клеток могут поглощать экзосомы, особенно остеобласты и эндотелиальные клетки сосудов, которые в наибольшей степени связаны с заживлением переломов. Наконец, при поглощении экзосом экспрессия генов в клетках-реципиентах изменяется, тем самым активируя различные сигнальные пути, вызывая различные клеточные и тканевые реакции и, в конечном счете, приводя к улучшению заживления переломов. (Рисунок 2)
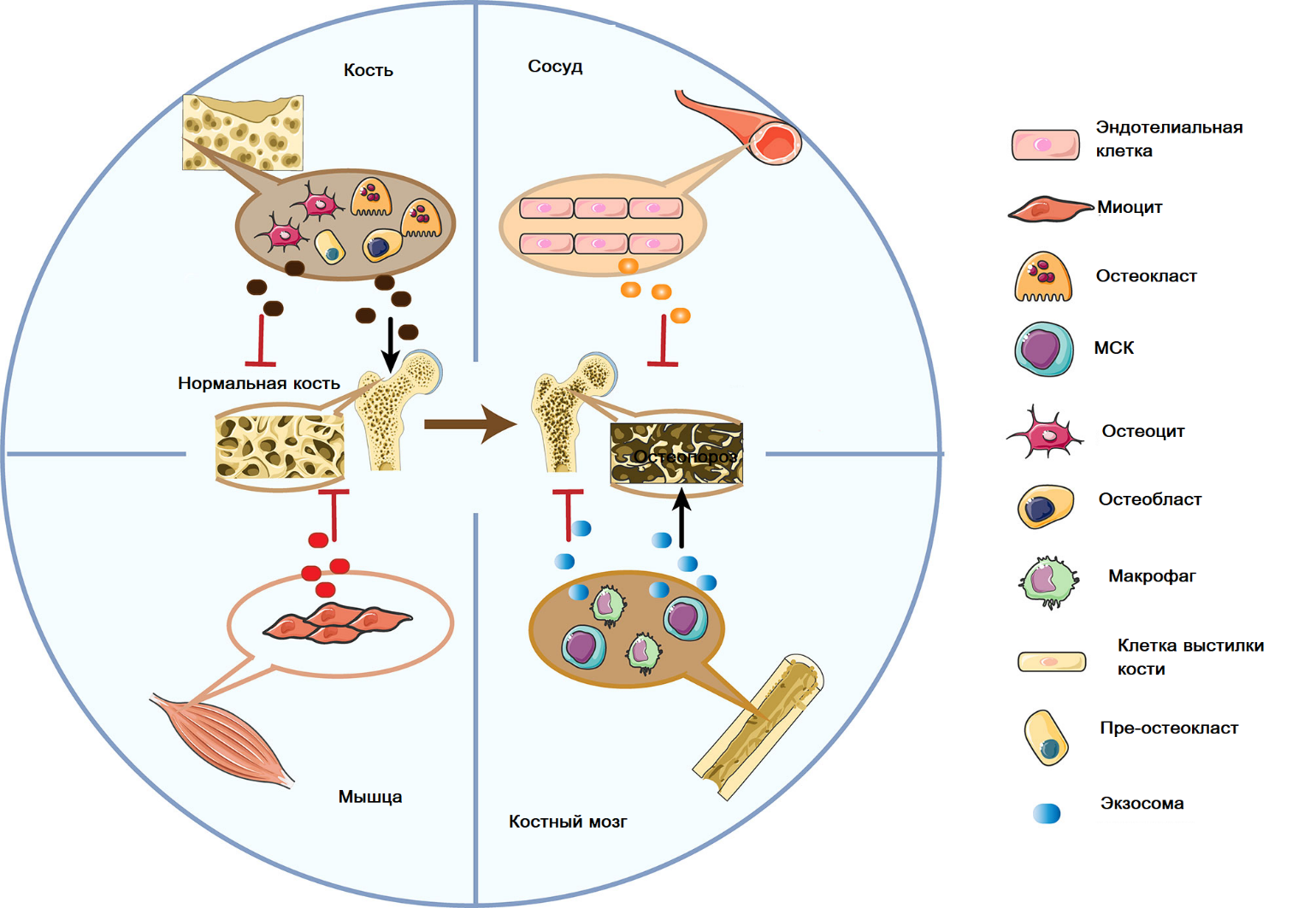
Рисунок 2
Дуплексные функции экзосом, полученных из клеток, связанных с костью, при остеопорозе. Экзосомы, секретируемые остеобластами и мезенхимальными стволовыми клетками, оказывают двустороннее действие, стимулируя и подавляя остеопороз; экзосомы, полученные из миоцитов и эндотелиальных клеток сосудов, в основном ингибируют процесс раскрытия.
НЕЙРОХИРУРГИЯ И ТЕРАПИЯ ЭКЗОСОМАМИ, ПОЛУЧЕННЫМИ ИЗ СТВОЛОВЫХ КЛЕТОК
ИШЕМИЧЕСКОГО ИНСУЛЬТА
Инсульты являются второй по значимости причиной смертности и третьей по значимости причиной инвалидности во всем мире, при этом ишемический инсульт является наиболее распространенным подтипом инсульта. Ключевые события во время ишемического каскада включают нейрональную дисфункцию, эксайтотоксичность, нейрохимическое повреждение и нейровоспаление. Что касается лечения, то в настоящее время проводятся клинические испытания нового поколения, в которых используются цитопротекторные препараты, такие как иммуномодуляторы, антагонисты рецепторов IL-6, ингибиторы Rho-киназы и средства, уничтожающие свободные радикалы. Практически все подтипы SC-exo продемонстрировали мощный терапевтический эффект при каждом из перечисленных выше патофизиологических проявлений о восстановлении после инсульта. Некоторые группы нацелены на нейропротекцию и нейрогенез. Во-первых, SC-exo терапия может ингибировать гибель нейрональных клеток.
Другие исследования in vitro и in vivo показали аналогичные антиапоптотические эффекты с использованием экзосом, полученных из EPC. Zhang et al. было обнаружено, что экзосомальный антиапоптотический эффект можно улучшить, предварительно обработав родительские НСК гамма-интерфероном (IFN-y).
Дуплексные функции экзосом, полученных из клеток, связанных с костью, при остеопорозе. Экзосомы, секретируемые остеобластами и мезенхимальными стволовыми клетками, оказывают двустороннее действие, стимулируя и подавляя остеопороз; экзосомы, полученные из миоцитов и эндотелиальных клеток сосудов, в основном ингибируют процесс раскрытия.
НЕЙРОХИРУРГИЯ И ТЕРАПИЯ ЭКЗОСОМАМИ, ПОЛУЧЕННЫМИ ИЗ СТВОЛОВЫХ КЛЕТОК
ИШЕМИЧЕСКОГО ИНСУЛЬТА
Инсульты являются второй по значимости причиной смертности и третьей по значимости причиной инвалидности во всем мире, при этом ишемический инсульт является наиболее распространенным подтипом инсульта. Ключевые события во время ишемического каскада включают нейрональную дисфункцию, эксайтотоксичность, нейрохимическое повреждение и нейровоспаление. Что касается лечения, то в настоящее время проводятся клинические испытания нового поколения, в которых используются цитопротекторные препараты, такие как иммуномодуляторы, антагонисты рецепторов IL-6, ингибиторы Rho-киназы и средства, уничтожающие свободные радикалы. Практически все подтипы SC-exo продемонстрировали мощный терапевтический эффект при каждом из перечисленных выше патофизиологических проявлений о восстановлении после инсульта. Некоторые группы нацелены на нейропротекцию и нейрогенез. Во-первых, SC-exo терапия может ингибировать гибель нейрональных клеток.
Другие исследования in vitro и in vivo показали аналогичные антиапоптотические эффекты с использованием экзосом, полученных из EPC. Zhang et al. было обнаружено, что экзосомальный антиапоптотический эффект можно улучшить, предварительно обработав родительские НСК гамма-интерфероном (IFN-y).
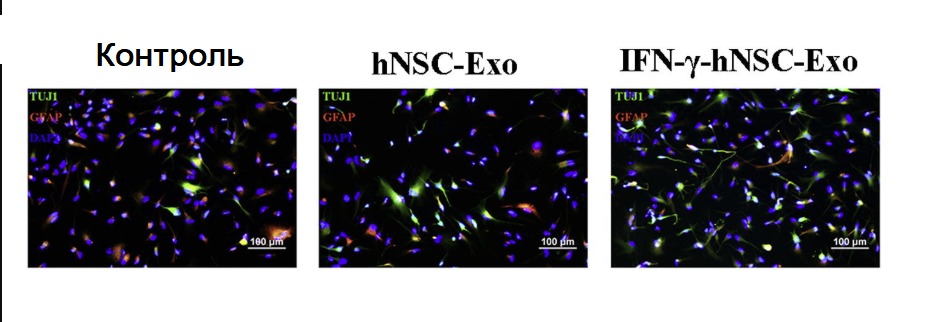
Рисунок. Обработка экзосомами влияла на дифференцировку hNSC, но количество нейронов (Tuj1-зеленый положительный результат) и астроцитов (GFAP-красный положительный результат) в группах hNSC-Exo и IFN-γ-hNSC-Exo статистически не различалось (** по сравнению с группами Exo). (**p < 0,01, ##p < 0,01 и n.s. не было значимым)
Zhang G. et al. Exosomes derived from human neural stem cells stimulated by interferon gamma improve therapeutic ability in ischemic stroke model //Journal of Advanced Research. – 2020. – Т. 24. – С. 435-445.
Во-вторых, экзо-терапия может защитить клетки ЦНС. Экзосомы, полученные из МСК костного мозга, могут предотвращать повреждения нервных клеток, вызванные OGD, путем подавления пироптоза, опосредованного воспалительными клетками NLRP3. Экзосомы, полученные из гипоксических культур, обладали более выраженным нейропротекторным эффектом, чем их аналоги из нормальных культур. Эта защита функции нейронов в условиях ишемии регулируется посредством пути PTEN/Akt. Экзосомы, полученные из NSC, могут также защищать астроциты, которые становятся поддерживающими реактивными астроцитами (RAs) после инсультов.
Zhang G. et al. Exosomes derived from human neural stem cells stimulated by interferon gamma improve therapeutic ability in ischemic stroke model //Journal of Advanced Research. – 2020. – Т. 24. – С. 435-445.
Во-вторых, экзо-терапия может защитить клетки ЦНС. Экзосомы, полученные из МСК костного мозга, могут предотвращать повреждения нервных клеток, вызванные OGD, путем подавления пироптоза, опосредованного воспалительными клетками NLRP3. Экзосомы, полученные из гипоксических культур, обладали более выраженным нейропротекторным эффектом, чем их аналоги из нормальных культур. Эта защита функции нейронов в условиях ишемии регулируется посредством пути PTEN/Akt. Экзосомы, полученные из NSC, могут также защищать астроциты, которые становятся поддерживающими реактивными астроцитами (RAs) после инсультов.
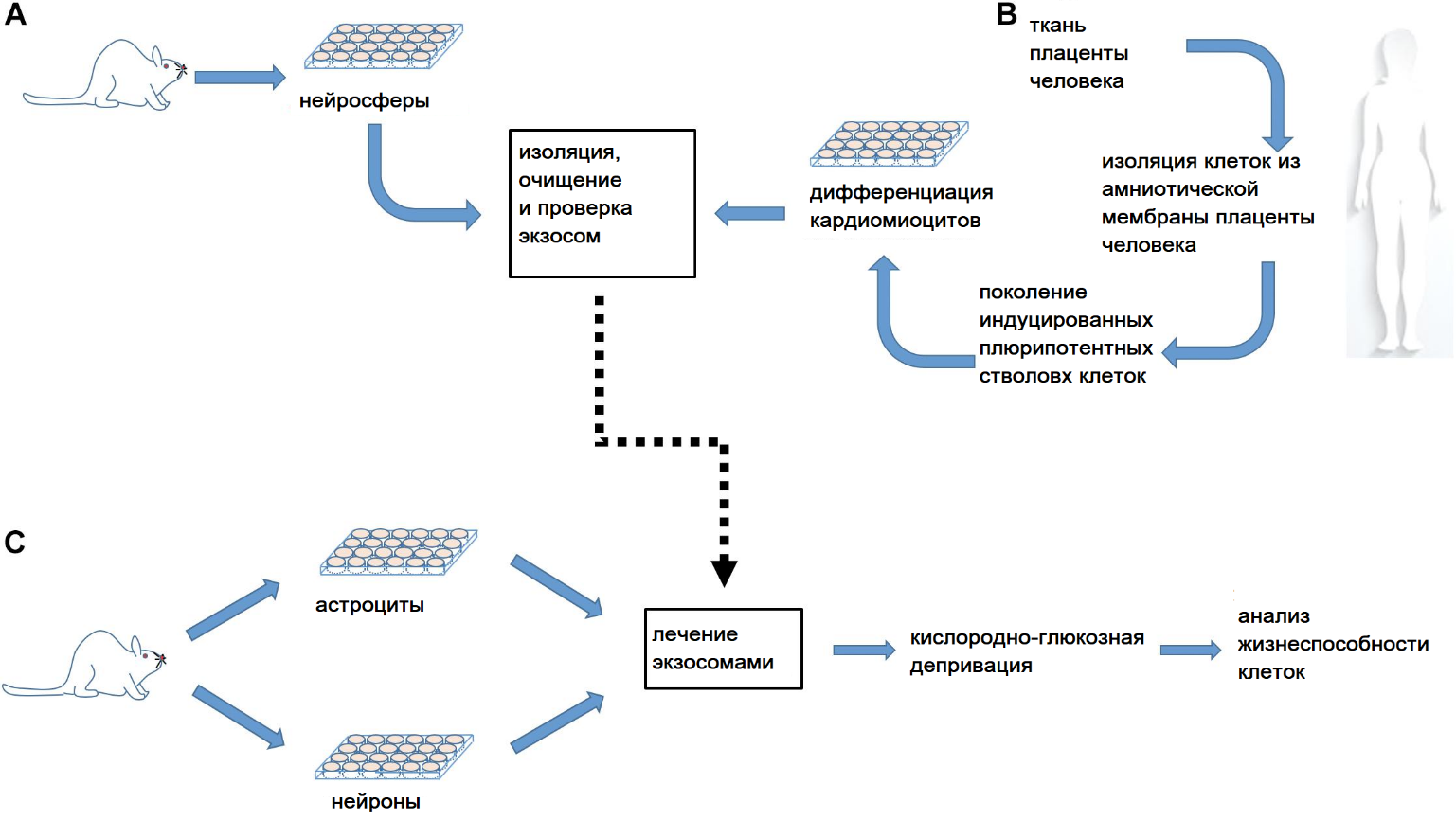
Рисунок . Рабочий процесс эксперимента. (А) Мышиные нервные стволовые клетки (NPC), выделенные из новорожденных мышей, культивировали в течение 2-3 дней до пролиферации в нейросферы, а затем обрабатывали для выделения экзосом, очистки и определения размера. (B) Параллельно экзосомы были выделены из культивируемых кардиомиоцитов, полученных из индуцированных плюрипотентных стволовых клеток человека (iPSC), полученных из амниотических мезенхимальных стволовых клеток человека (HAMSC). (C) Первичные культуры астроцитов коры головного мозга получали от мышей на 1-3-й день после рождения, высевали в течение 21 дня, а затем подвергали 6-часовой комбинированной кислородно-глюкозной депривации (OGD) с обработкой экзосомами или без нее с последующей 24-часовой реперфузией перед анализом жизнеспособности клеток. Культуры нейронов, полученные из коры головного мозга зародышей мышей на 15-16-й эмбриональный день, высевали на 12-13-й день, а затем подвергали 70-минутной ОГД с обработкой экзосомами или без нее с последующей 24-часовой реперфузией перед анализом жизнеспособности клеток.